Стероидные противовоспалительные препараты. Классификация. Механизм действия и фармакологические эффекты.
Стероидные противовоспалительные препараты созданы на основе глюкокортикоидов естественных гормонов коры надпочечников.
Классификация
- Естественные глюкокортикоиды: кортизон, гидрокортизон.
- Синтетические глюкокортикоиды
- Негалогенизированные: метилпреднизолон, преднизолон. Галогенизированные (фторированные): бетаметазон (дипроспан*), дексаметазон, триамцинолон (кеналог*, полькортолон*, триакорт*).
Механизм действия и фармакологические эффекты
Глюкокортикоиды — гормоны, вырабатываемые корой надпочечников. Выделение их регулируется адренокортикотропным гормоном (АКТГ) гипофиза. Действуют глюкокортикоиды внутриклеточно на уровне ядерных структур, взаимодействуя со специфическими глюкокортикоидными рецепторами в цитоплазме клеток-мишеней. Образовавшийся гормонорецепторный комплекс подвергается конформационным изменениям, активируется, проникает в ядро клетки, где, связываясь с ДНК, оказывает влияние на экспрессию ряда генов. Влияя на транскрипцию широкого спектра генов, глюкокортикоиды оказывают существенное влияние на углеводный, белковый, жировой, пуриновый обмены и водно-солевой баланс. Активируя глюконеогенез в печени посредством утилизации аминокислот и снижая захват глюкозы клетками периферических тканей, глюкокортикоиды повышают концентрацию глюкозы в крови и гликогена в печени. Они тормозят биосинтез белка и усиливают его катаболизм в мышцах, соединительной ткани и коже, оказывают антианаболический эффект. При длительном их применении наблюдаются мышечная слабость, остеопороз, замедление процессов регенерации, у детей задержка роста, происходит перераспределение жира с увеличением его содержания в области верхней половины туловища, увеличивается концентрация жирных кислот и триглицеридов, развивается гиперхолестеринемия. За счет мине-ралокортикоидной активности глюкокортикоиды задерживают натрий и воду и увеличивают выведение калия и кальция.
В медицинской практике глюкокортикоиды используют в качестве высокоактивных противовоспалительных, противоаллергических, противошоковых и иммуносупрессивных средств.
Механизм противовоспалительного действия. Глюкокортикоиды — активные ингибиторы всех фаз воспалительной реакции. Стабилизируя мембраны клеток и органелл (особенно лизосомальных), они ограничивают выход из клетки протеолитических ферментов, тормозят образование свободных радикалов кислорода и перекисей липидов в мембранах, предупреждают деструкцию тканей. Действуя на экспрессию генов, они индуцируют биосинтез в лейкоцитах липокортинов белковых ингибиторов фосфолипазы А2и уменьшают образование в очаге воспаления ЦОГ-2, что ограничивает продукцию арахидоновой кислоты из фосфолипидов клеточных мембран и синтез ее метаболитов медиаторов воспаления (проста-ноидов, лейкотриенов и фактора, активирующего тромбоциты). Под влиянием глюкокортикоидов уменьшается в очаге воспаления количество тучных клеток, вырабатывающих гиалуроновую кислоту, суживаются мелкие сосуды, снижается проницаемость капилляров, уменьшается экссудация жидкости. Глюкокортикоиды препятствуют прилипанию нейтрофилов и моноцитов к эндотелию сосудов, ограничивают их проникновение в ткани, снижают активность макрофагов и фибробластов, подавляют лимфопоэз, синтез гликозаминогликанов и белков, угнетают фазу пролиферации.
Учитывая иммунодепрессивное действие глюкокортикоидов, при воспалении инфекционного генеза их следует сочетать с антимикробной терапией.
Иммунодепрессивный эффект глюкокортикоидов обусловлен снижением уровня циркулирующих лимфоцитов и макрофагов, нарушением продукции и действия ряда интерлейкинов и других цитокинов, регулирующих различные фазы иммунного ответа, подавлением активности Т- и В-лимфоцитов, снижением продукции иммуноглобулинов, понижением содержания комплемента в крови, образованием фиксированных иммунных комплексов, угнетением образования фактора, ингибирующего миграцию макрофагов.
Противоаллергигеское действие глюкокортикоидов обусловлено подавлением различных стадий иммуногенеза. Они замедляют созревание и снижают количество циркулирующих базофилов, блокируют синтез и высвобождение из сенсибилизированных тучных клеток и базофилов медиаторов аллергии немедленного типа (гистамина, гепарина, серотонина и др.) и снижают чувствительность к ним эффекторных клеток, подавляют развитие лимфоидной и соединительной ткани, уменьшают количество Т- и В-лимфоцитов и тучных клеток, угнетают антителообразование.
Противошоковое и антитоксигеское действие глюкокортикоидов обусловлено участием их в регуляции сосудистого тонуса, водно-солевого баланса, а также повышением активности ферментов печени, участвующих в процессах биотрансформации эндогеных и экзогенных веществ. Они повышают чувствительность сосудов к катехоламинам и усиливают действие ангиотензина II, уменьшают проницаемость сосудов, задерживают натрий и воду, вследствие чего возрастает объем плазмы крови, уменьшается гиповолемия, нормализуется сосудистый тонус, улучшается сократимость миокарда, повышается АД.
Стероидные противовоспалительные препараты. Классификация. Механизм действия и фармакологические эффекты.
Болят ноги? Сохраните ссылку
Стероидные противовоспалительные препараты созданы на основе глюкокортикоидов естественных гормонов коры надпочечников.
Классификация
Естественные глюкокортикоиды: кортизон, гидрокортизон. Синтетические глюкокортикоиды Негалогенизированные: метилпреднизолон, преднизолон. Галогенизированные (фторированные): бетаметазон (дипроспан*), дексаметазон, триамцинолон (кеналог*, полькортолон*, триакорт*).
Механизмдействияфармакологическиеэффекты
Глюкокортикоиды — гормоны, вырабатываемые корой надпочечников. Выделение их регулируется адренокортикотропным гормоном (АКТГ) гипофиза. Действуют глюкокортикоиды внутриклеточно на уровне ядерных структур, взаимодействуя со специфическими глюкокортикоидными рецепторами в цитоплазме клеток-мишеней. Образовавшийся гормонорецепторный комплекс подвергается конформационным изменениям, активируется, проникает в ядро клетки, где, связываясь с ДНК, оказывает влияние на экспрессию ряда генов. Влияя на транскрипцию широкого спектра генов, глюкокортикоиды оказывают существенное влияние на углеводный, белковый, жировой, пуриновый обмены и водно-солевой баланс. Активируя глюконеогенез в печени посредством утилизации аминокислот и снижая захват глюкозы клетками периферических тканей, глюкокортикоиды повышают концентрацию глюкозы в крови и гликогена в печени. Они тормозят биосинтез белка и усиливают его катаболизм в мышцах, соединительной ткани и коже, оказывают антианаболический эффект. При длительном их применении наблюдаются мышечная слабость, остеопороз, замедление процессов регенерации, у детей задержка роста, происходит перераспределение жира с увеличением его содержания в области верхней половины туловища, увеличивается концентрация жирных кислот и триглицеридов, развивается гиперхолестеринемия. За счет мине-ралокортикоидной активности глюкокортикоиды задерживают натрий и воду и увеличивают выведение калия и кальция.
В медицинской практике глюкокортикоиды используют в качестве высокоактивных противовоспалительных, противоаллергических, противошоковых и иммуносупрессивных средств.
Механизм противовоспалительного действия. Глюкокортикоиды — активные ингибиторы всех фаз воспалительной реакции. Стабилизируя мембраны клеток и органелл (особенно лизосомальных), они ограничивают выход из клетки протеолитических ферментов, тормозят образование свободных радикалов кислорода и перекисей липидов в мембранах, предупреждают деструкцию тканей. Действуя на экспрессию генов, они индуцируют биосинтез в лейкоцитах липокортинов белковых ингибиторов фосфолипазы А2и уменьшают образование в очаге воспаления ЦОГ-2, что ограничивает продукцию арахидоновой кислоты из фосфолипидов клеточных мембран и синтез ее метаболитов медиаторов воспаления (проста-ноидов, лейкотриенов и фактора, активирующего тромбоциты). Под влиянием глюкокортикоидов уменьшается в очаге воспаления количество тучных клеток, вырабатывающих гиалуроновую кислоту, суживаются мелкие сосуды, снижается проницаемость капилляров, уменьшается экссудация жидкости. Глюкокортикоиды препятствуют прилипанию нейтрофилов и моноцитов к эндотелию сосудов, ограничивают их проникновение в ткани, снижают активность макрофагов и фибробластов, подавляют лимфопоэз, синтез гликозаминогликанов и белков, угнетают фазу пролиферации.
Учитывая иммунодепрессивное действие глюкокортикоидов, при воспалении инфекционного генеза их следует сочетать с антимикробной терапией.
Иммунодепрессивный эффект глюкокортикоидов обусловлен снижением уровня циркулирующих лимфоцитов и макрофагов, нарушением продукции и действия ряда интерлейкинов и других цитокинов, регулирующих различные фазы иммунного ответа, подавлением активности Т- и В-лимфоцитов, снижением продукции иммуноглобулинов, понижением содержания комплемента в крови, образованием фиксированных иммунных комплексов, угнетением образования фактора, ингибирующего миграцию макрофагов.
Противоаллергигеское действие глюкокортикоидов обусловлено подавлением различных стадий иммуногенеза. Они замедляют созревание и снижают количество циркулирующих базофилов, блокируют синтез и высвобождение из сенсибилизированных тучных клеток и базофилов медиаторов аллергии немедленного типа (гистамина, гепарина, серотонина и др.) и снижают чувствительность к ним эффекторных клеток, подавляют развитие лимфоидной и соединительной ткани, уменьшают количество Т- и В-лимфоцитов и тучных клеток, угнетают антителообразование.
Противошоковое и антитоксигеское действие глюкокортикоидов обусловлено участием их в регуляции сосудистого тонуса, водно-солевого баланса, а также повышением активности ферментов печени, участвующих в процессах биотрансформации эндогеных и экзогенных веществ. Они повышают чувствительность сосудов к катехоламинам и усиливают действие ангиотензина II, уменьшают проницаемость сосудов, задерживают натрий и воду, вследствие чего возрастает объем плазмы крови, уменьшается гиповолемия, нормализуется сосудистый тонус, улучшается сократимость миокарда, повышается АД.
Другие статьи
СТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА (ГЛЮКОКОРТИКОИДЫ).
1. Природные:Гидрокортизон*, Кортизон*.
2. Синтетические:Преднизолон*, Метилпреднизолон*, Дексаметазон*. Триамцинолон*.
3.Препараты для местного применения: мази — Преднизолоновая, «Ледекорт», «Фторокорт» (Триамцинолон*), «Синафлан» (Флуоцинолона ацетонид*), «Лоринден»; выпускаемые в виде аэрозолей для ингаляций Беклометазона дипропионат* («Бекотид», «Беклазон»), Ингакорт, Будезонид*, Флутиказон*.
Отличие синтетических глюкокортикоидов от природных состоит в том, что первые более активны, а значит, их можно использовать в низких дозах, с меньшим риском осложнений и меньшей вероятностью изменений водно-солевого обмена.
После проникновения в ткани глюкокортикоиды диффундируют через клеточные мембраны и связываются с цитоплазматическим комплексом, состоящим из специфического глюкокортикоидного рецептора и белка теплового шока. Белок теплового шока высвобождается и комплекс гормон-рецептор транспортируется в ядро, где взаимодействует с глюкокортикоидными эффекторными элементами на различных генах и с другими регуляторными белками (специфичными для разных клеток). Это приводит к увеличению синтеза мРНК, которая, в свою очередь, индуцирует образование особого класса белков — липокортинов, один из них (липомодулин) ингибирует фосфолипазу А2. Кроме того, угнетают выход из лимфоцитов и макрофагов цитокинов (интерлейкинов 1 и 2 и у-интерферона). А также непосредственно и соответственно, собирание документов и всевозможного мелкого прайса, на угар и содомию;)))
Влияние на различные виды обменов.
Действуют на белковый, углеводный, жировой и водно-солевой (таблица).
Влияние глюкокортикоидов на различные виды обменов.
Воспаление является универсальной реакцией организма на воздействие разнообразных повреждающих факторов: физических, химических, бактериальных, вирусных и других. При этом возникает очаг поражения, в котором образуются медиаторы воспаления: простагландины, гистамин, серотонин, лейкотриены и других биологически активные вещества, стимулирующие дальнейшее развитие воспалительного процесса. Это сопровождается отеком органа, повышением температуры, изменениями кровеносных сосудов, болевым синдромом.
Классификация противовоспалительных средств:
Противовоспалительные средства влияют на образование биологически активных веществ из фосфолипидов клеточных мембран, принимающих участие в воспалительном процессе. Основная направленность действия таких веществ сводится к следующему:
1. Ингибирование фосфолипазы А2, контролирующей образование простагландинов и лейкотриенов (стероидные противовоспалительные средства (СПВС) – глюкокортикоиды);
2. Ингибирование циклооксигеназы, регулирующей биосинтез простагландинов, тромбоксана, простациклина (нестероидные противовоспалительные средства (НПВС);
Противовоспалительные средства оказывают действие на синтез и выделение медиаторов воспаления, устраняют воспалительный процесс, не влияя на причину воспалительной реакции.
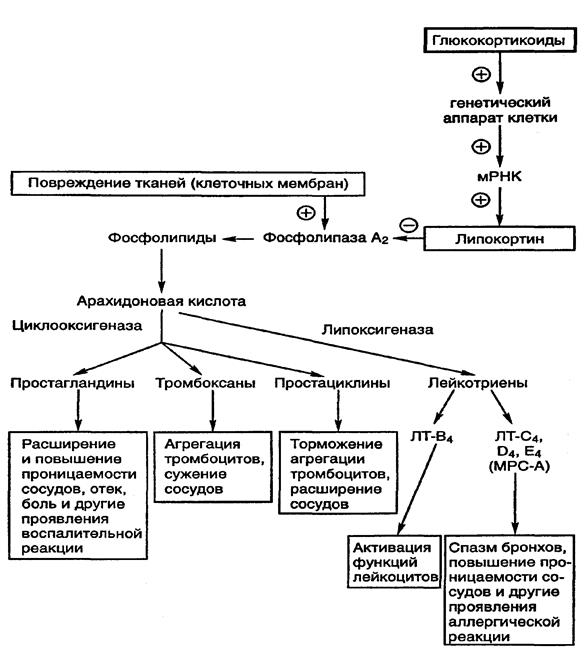
Рис. 28 «Каскад арахидоновой кислоты» и механизм действия ПВС
К стероидным противовоспалительным средствам относятся глюкокортикоиды. Механизм их противовоспалительного действия связан с угнетением синтеза простагландинов через блокаду активности фермента фосфолипазы А2, необходимой для синтеза арахидоновой кислоты. Они стабилизируют мембрану клеток, угнетают образование простагландинов и лейкотриенов, снижают проницаемость стенок сосудов и обладают наиболее выраженным противовоспалительным действием. (Рис.28).
Эти лекарственные средства назначают при неэффективности НПВС при ревматоидном артрите, миозитах, коллагенозах и др. (См. «Гормональные лекарственные средства коры надпочечников»).
Механизм противовоспалительного действия НПВС заключается в ингибировании синтеза простагландинов путем угнетения активности фермента циклооксигеназы (ЦОГ). НПВС – лекарственные средства, проявляющие противовоспалительное, болеутоляющее, жаропонижающее действие. К ним относятся ненаркотические (неопиоидные) анальгетики (См. «Анальгетики»). Их применяют при ревматических заболеваниях, травмах, ушибах, почечной и печеночной колике, радикулитах, лихорадке, болевом синдроме различной этиологии.
В связи с тем, что существует как минимум две разновидности ЦОГ (ЦОГ-1 и ЦОГ-2), НПВС классифицируют следующим образом:
1. Неселективные ингибиторы ЦОГ-1 и ЦОГ-2
Производные индолуксусной кислоты (индометацин)
Производные гетероарилуксусной кислоты (кеторолак)
Производные фенилуксусной кислоты (диклофенак-натрий)
Производные пропионовой кислоты (ибупрофен, кетопрофен, напроксен)
Оксикамы (пироксикам, лорноксикам, теноксикам)
2. Селективные ингибиторы ЦОГ-1
Производные салициловой кислоты
(кислота ацетилсалициловая – в малых дозах)
3.Селективные ингибиторы ЦОГ-2
Коксибы (целекоксиб, рофекоксиб)
Производные индолуксусной кислоты
Индометацин (метиндол, индовис) – один из наиболее эффективных НПВС с выраженной противовоспалительной активностью. Хорошо всасывается из желудочно-кишечного тракта, используется в различных лекарственных формах. Назначается 3 – 4 раза в день.
Является токсичным лекарственным средством. Нежелательные побочные эффекты проявляются в изъязвлении слизистой оболочки, желудочных кровотечениях, угнетении кроветворения (лейкопения, апластическая анемия), головной боли, депрессии, галлюцинациях, нарушении зрения, изменении хрящей. Неблагоприятное влияние наблюдается у значительной части больных – 30-50%. Индометацин противопоказан при психических заболеваниях, эпилепсии, язвенной болезни желудка и двенадцатиперстной кишки.
Производные фенилуксусной кислоты
Диклофенак-натрий(ортофен, вольтарен, дикломакс, румакар, вурдон, фелоран, алмирал) является одним из наиболее эффективных противовоспалительных средств. Обладает также болеутоляющим и жаропонижающим действием. Нежелательные эффекты проявляются в меньшей степени. «Паноксен» – комбинированное ЛС с парацетамолом.
Для защиты слизистой желудка при применении НПВС одновременно назначается ЛС простагландинов Мизопростол (сайтотек, цитотек), а также выпускается комбинированный препарат «Артротек» (диклофенак+ мизопростол). Для предупреждения отрицательного воздействия НПВС на желудок промышленность выпускает таблетки, покрытые кишечнорастворимыми оболочками. Используются также ЛС для местного применения (мази, кремы, гели).
Производные гетероарилуксусной кислоты
Кеторолак (кетанов, кеторол) наиболее эффективен как болеутоляющее средство и в этом отношении сопоставим с опиоидными анальгетиками. Противовоспалительное действие выражено у него в небольшой степени. Применяется для подавления боли в послеоперационном периоде, при опухолях, травмах, почечной колике. Выражено отрицательное влияние на ЖКТ и почки.
Производные пропионовой кислоты
Ибупрофен (бруфен, нурофен, долгит) оказывает болеутоляющее и жаропонижающее действие. Эффективен при приеме внутрь. Менее выражено противовоспалительное действие. Является малотоксичным. Наиболее типичными осложнениями являются тошнота, понос, боли в животе. Входит в состав комбинированных ЛС: «Брустан», «Ибуклин», «Брус» в сочетании с парацетамолом.
Кетопрофен (фастум, кетонал, ОКИ, фастомед) по структуре и действию близок к ибупрофену и диклофенаку.
Напроксен (напросин) оказывает более продолжительное действие, назначается 2 раза в сутки. Обладает противовоспалительным, болеутоляющим и жаропонижающим действием. Обычно хорошо переносится.
Пироксикам (роксикам), Лорноксикам (ксефокам), Теноксикам (окситен) оказывают выраженное болеутоляющее действие. Отличаются более длительным эффектом, назначаются 1-2 раза в сутки. Могут вызвать диспепсические явления, кожные аллергические реакции, желудочные кровотечения, боль в животе, нарушение функции печени, головная боль, сонливость.
Селективные ингибиторы циклооксигеназы-2 (ЦОГ-2) угнетают активность фермента и синтез простагландинов в очаге воспаления, поэтому в значительно меньшей степени вызывают нежелательные побочные эффекты со стороны желудка, крови и других органов.
К этой группе относятся Мелоксикам (мовалис, мовалокам), Нимесулид (найз, нимесил). Назначают их при ревматоидном артрите, артрозах и других аналогичных заболеваниях 1 раз в сутки. Они обладают противоотечным, противовоспалительным, анальгезирующим, жаропонижающим действием.
«Диган» — комплексное ЛС, в состав которого входят нимесулид и спазмолитик дицикломин. Применяется для купирования боли, обусловленной спазмом гладких мышц, а также при мышечной, суставной боли.
Высокоселективными неконкурентными ингибиторами ЦОГ-2 являются Рофекоксиб (рофил), Целекоксиб (целебрекс). Рекомендуются при остеоартрите, ревматоидном артрите, при болях слабой и средней интенсивности. Из побочных эффектов проявляются аллергические реакции, кардиотоксичность, нефротоксичность.
К базисным, длительно действующим противовоспалительным средствам относятся препараты золота – Кризанол,D-пеницилламин (купренил), Хлорохин, Сульфасалазин, Метотрексат и другие иммунодепрессанты. Общим свойством этих ЛС является способность тормозить развитие костных эрозий и деструкцию хрящей суставов при развитии неспецифических воспалительных реакций. Они проявляют сложное непрямое влияние на местный воспалительный процесс, опосредованное через патогенетические факторы иммунного звена воспаления. Терапевтический эффект развивается медленно (в течение 10-12 недель) и сохраняется в течение нескольких месяцев после отмены.
Лекарственные средства, подавляющие развитие воспалительного процесса, называют противовоспалительными препаратами. Воспалительный процесс — это универсальная реакция организма на действие повреждающих факторов внешней среды: инфекционных, химических, физических и пр. Во многих случаях воспаление играет защитную роль, способствует ограничению очага повреждения и уничтожению инфекционного агента. Но при генерализированных формах такой процесс может приводить к значительному повреждению органов и тканей с нарушением их функции. В случаях, когда возможно этиотропное лечение, оно способствует уменьшению и исчезновению воспаления, и нет необходимости в применении противовоспалительных средств, тогда как при системных воспалительных заболеваниях соединительной ткани, характеризующихся хроническим прогрессирующим течением, которое на определенном этапе может приводить к инвалилидизации больных, раннее применение средств противовоспалительного действия является обязательным компонентом лечения.
Классификация противовоспалительных средств
- нестероидные противовоспалительные средства (НПВС);
- стероидные противовоспалительные средства (СПВС);
- противовоспалительные средства медленного действия, или средства «базисной» терапии.
Нестероидные противовоспалительные средства [ править ]
При воспалительных процессах мышц, суставов, костной ткани (ревматоидных заболеваниях) чаше используют НПВС, которые обладают противовоспалительным, аналтезирующим и жаропонижающим действием. История открытия этих веществ начинается с использования салицилатов (1864). Все препараты характеризируются неспецифичностью действия, т. е. противовоспалительный эффект выражен при воспалении любого генеза и локализации процесса. В наше время НПВС, в том числе ингибиторы, являются наиболее часто применяемыми в мире классами лекарств. Ежегодная продажа этих препаратов, как по рецептам врачей, так и в целях самолечения (в несколько раз больше), превышает сумму 6 млрд доларов.
Классификация НПВС по химическому строению
1. Производные кислоты салициловой — кислота ацетилсалициловая (аспирин), ацетил салицилат лизина, бен-гей (комбинированный препарат).
2. Производные пиразолона — анальгин, фенилбутазон (бутадион, в Украине снят с производства).
3. Производные антраниловой кислоты — мефенамовая и флуфенамовая кислоты, натрия мефенаминат.
4. Производные пропионовой кислоты — ибупрофен, напроксен, кетотифен, сургам, флурбипрофен.
5. Производные уксусной кислоты — диклофенак-натрий, индометацин, сулиндак, набуметон.
6. Производные оксикамов — пироксикам, лорноксикам, мелоксикам.
7. Производные кислоты изоникотиновой — амизон.
8. Производные коксибов — целекоксиб, рофекоксиб.
9. Производные других химических групп — этодолак, набуметон, месулид.
10. Комбинированные препараты — реопирин, копацил, диклокаин.
Классификация НПВС по механизму действия
1. Селективне ингибиторы ЦОГ-1 — кислота ацетилсалициловая в малых дозах.
2. Неселективные ингибиторы ЦОГ-1 и ЦОГ-2 — большинство НПВС.
3. Препараты с преимущественным влиянием на ЦОГ-2 — мелоксикам, нимесулид.
4. Высокоселективные ингибиторы ЦОГ-2 — целекоксиб, рофекоксиб.
Фармакодинамика. Основным механизмом противовоспалительного действия НПВС, как и аналгетиков-антипиретиков, является угнетение циклооксигеназы (ЦОГ) — ключевого фермента, принимающего участие в превращении арахидоновой кислоты в эндопероксиды, из которых синтезируются простагландины и тромбоксан.
В очаге воспаления под действием различных повреждающих факторов активируется фермент фосфолипаза А, (ФЛА,), под влиянием которой из фосфолипидов клеточных мембран и освобождается арахидоновая кислота. Простагландины (ПГ) являются медиаторами и модуляторами воспаления, болевого синдрома и лихорадки.
Ингибирование ЦОГ резко сокращает уровень ПГ, ответственных за основные симптомы воспаления: отек, расширение сосудов, жар, боль, т. е. терапевтической мишенью противовоспалительных препаратов является фермент ЦОГ: ЦОГ-1, ЦОГ-2 и ЦОГ-3. Первая принимает участие в важнейших физиологических процессах, в частности в синтезе простациклина и других простагландинов, регулирующих целостность слизистой оболочки желудочно-кишечного тракта, функцию тромбоцитов и кровообращение в почках. Уровень ЦОГ-2 в нормальных условиях низкий и возрастает под влиянием цитокинов и других противовоспалительных агентов. Этот фермент принимает участие в синтезе простаноидов, необходимых для развития и поддержания воспаления, поэтому противовоспалительное действие нестероидных противовоспалительных средств обусловлено угнетением ЦОГ-2, а побочные реакции — ЦОГ-1, ЦОГ-3 функционирует в структурах ЦНС.
Для препаратов нового поколения (мелоксикам, месулид, теноксикам, лориоксикам, эльде-рин, солпафлекс, набуметон и др.) отличительным в механизме действия от традиционных НПВС является избирательное угнетение ПГ, что приводит к выраженной противовоспалительной активности новых препаратов и одновременно к низкой степени развития осложнений при их длительном применении.
Высокоселективным специфическим ингибитором ЦОГ-2 является целекоксиб, он обладает очень низким сродством с ЦОГ-1, поэтому не влияет на синтез тех ПГ, которые отвечают за физиологические процессы в слизистой оболочке желудка и тромбоцитах.
Механизм действия НПВС связан также со многими звеньями патогенеза воспаления, боли и лихорадки и включает ряд процессов.
Так, угнетение противовоспалительными средствами экссудативной фазы воспаления является следствием снижения активности медиаторов воспаления — ПГ, брадикинина, гистамина, серотонина, что ведет к уменьшению проницаемости сосудистой стенки. При воспалении происходит высвобождение и взаимодействие ПГ и других медиаторов воспаления.
Простагландины сенсибилизируют ноцирецепторы, сосуды, ткани, повышают и реактивность к действию неспецифических медиаторов воспаления (гистамин, серотонин, кинины, комплемент, микросомальные ферменты). В свою очередь гистамин играет роль пускового механизма воспаления, расширяет микрососуды, повышает их проницаемость.
Серотонин также увеличивает проницаемость сосудов. Кинины могут вызывать основные проявления воспаления — расширение сосудов, боль, усиливать соответствующие эффекты гистамина и серотонина, биосинтез ПГЕ, и ПГЕ2. Наряду с медиаторной ролью ПГ могут быть модуляторами воспаления, влияя на агрегацию тромбоцитов (ингибируют биосинтез тромбоксана). На поздних стадиях в воспалении участвуют комплемент, лизосомальные ферменты и другие медиаторы (кинины, лейкотриены). Важным компонентом механизма действия является местный эффект: они предупреждают выход из клетки лизосомаль-ных ферментов и уменьшают степень развития воспалительного процесса.
Антигиалуронидазная активность НПВС также способствует уменьшению проницаемости (противоотечный эффект) сосудов и клеточных мембран в очаге воспаления.
Нестероидные противовоспалительные средства угнетают окислительное фосфорилирование, что нарушает синтез гликозаминогликанов, а это тормозит процессы пролиферации; подавляет развитие фиброзной фазы воспаления при ревматизме.
Тормозя свободнорадикальные реакции, НПВС уменьшают тем самым уровень свободных радикалов кислорода, которые повреждают клеточные мембраны в месте воспаления и способствуют его распространению.
Эти противовоспалительные средства блокируют образование АТФ и этим уменьшают энергообеспечение воспалительной реакции.
Снижение интенсивности воспалительной реакции, отека тканей под влиянием НПВС сопровождается уменьшением болевых ощущений. Снижая образование ПГЕ, и ПГЕ2, НПВС уменьшают их потенциирущее действие на болевые рецепторы и поступление болевых импульсов в ЦНС. Кроме того, препараты этой группы ограничивают накопление ПГ в структурах головного мозга, участвующих в восприятии боли. Это приводит к уменьшению болевого синдрома, особенно связанного с воспалительной реакцией — центральный механизм. Значение противовоспалительных свойств НПВС в снижении боли обусловлено также и чисто механическими факторами. Уменьшение отека снижает давление на барорецепторы, способствует ослаблению болевых ощущений — периферический механизм.
Жаропонижающий эффект НПВС связан с их способностью угнетать синтез ПГ и других пирогенов, вызывающих гипертермическую реакцию, а также с угнетающим действием на центральные механизмы температурной реакции. НПВС уменьшают содержание ПГ в спинномозговой жидкости и снижают активирующее влияние пирогенов на центр терморегуляции в гипоталамусе. Это обусловливает увеличение теплоотдачи и усиление потоотделения вследствие понижения температуры тела.
Амизон обладает иммуномодулирующим эффектом, усиливая гуморальный и клеточный иммунитет, влияя на факторы природной противомикробной резистентности (уровень лизоцима). Амизон является активным пероральным индуктором эндогенного интерферона. Иммуномодулируюшие свойства имеются также у кислоты мефенамовой.
Нестероидным противовоспалительным средствам (ацетилсалициловая кислота, ацетилсали-цилат лизина, кетопрофен, диклофенак-натрий, нифедипиновая кислота, индометацин, артротек, анапирин) свойственен также антиагрегантный эффект. Десенсибилизирующее действие характерно для индометацина, диклофенак-натрия, ацетилсалициловой кислоты.
По степени противовоспалительной активности НПВС можно расположить следующим образом: индометацин = диклофенак > мелоксикам > нимесулид > пироксикам > кетопрофен > напроксен > ибупрофен > ацетилсалициловая кислота.
Ненаркотический аналгетик парацетамол (параацетаминофен) обладает высокой аналгезирующей и антипиретической активностью, но противовоспалительный эффект у него практически отсутствует. Уже в небольших дозах он угнетает изоформу ЦОГ-3 в структурах ЦНС и не влияет на этот фермент в периферических тканях.
Приводим далее сравнительную характеристику препаратов.
Салицилаты [ править ]
Кислота ацетилсалициловая (аспирин) — НПВС, используемое в клинике более 100 лет. В наше время ежегодно производится около 50 тысяч тонн аспирина.
Фармакокинетика. Кислота ацетилсалициловая (АСК) всасывается в желудке и верхних отделах тонкой кишки. Латентный период составляет 30 мин, максимальное содержание в плазме крови наблюдается через 2 ч, длительность действия — 4—6 ч. Как противовоспалительное средство АСК назначают в суточной дозе 3—4 г (до 6 г). Кинетика АСК зависит от дозы: при применении в дозе 300—400 мг ее уровень в плазме повышается пропорционально, при увеличении разовой дозы препарата до 1—2 г его концентрация в плазме крови возрастает непропорционально быстро, что может привести к развитию интоксикации, поэтому разовая доза не должна превышать 1 г.
Используется при ревматизме, инфекционно-аллергическом миокардите, ревматоидном полиартрите, системной красной волчанке и пр. Производные салициловой кислоты применяют преимущественно при воспалительных процессах и болевых синдромах умеренной силы (миозит, миалгия, артралгия, невралгия, зубная, головная боль, дисменоррея). Как антиагрегант АСК действует на начальную фазу тромбообразования в небольших дозах — 0,08—0,3 г в день или через день. В таких дозах препарат нарушает синтез тромбоксана А, путем ацетилирования ЦОГ. Ан-тиагрегантное действие сохраняется на протяжении 4—7 дней, поскольку ингибирующее влияние на ЦОГ тромбоцитов необратимо. В указанных дозах АСК назначают для предупреждения послеоперационных тромбов, при наличии тромбофлебитов, тромбоза сосудов сетчатки, нарушениях мозгового кровообращения, а также для профилактики тромбозмболических осложнений при стенокардии и инфаркте миокарда.
Лизина ацетилсалицилат — водорастворимая форма АСК — применяется для парентерального введения.
Бен-гей — комбинированный препарат группы салицилатов, в состав которого входят метил салицилат и ментол, проявляет выраженное аналгезирующее и разогревающее действие. Используется для местного применения при мышечной и суставной боли. В форме мази, спортивного бальзама используется для снятия мышечного напряжения перед тренировками и после них, а также — для снятия болевого синдрома при миалгии и артралгии.
Побочные эффекты: осложнения терапии салицилатами связаны с раздражением слизистой оболочки. Блокада ПГ слизистой оболочки, которые угнетают секрецию хлористоводородной кислоты и повышают выделение слизи, приводит к обострению язвенной болезни желудка. Возможны развитие аллергических реакций в виде сыпи, приступы бронхиальной астмы, анафилактический шок. У беременных салицилаты Moiyr задерживать наступление родовой деятельности, в конце беременности могут способствовать преждевременному зарашиванию боталлового протока, что приводит к рождению ребенка с соответствующей сердечной патологией. В случаях длительного применения развивается хроническое отравление — салицизм, характеризируюшийся головной болью, снижением слуха, нарушением сознания, угнетением, сонливостью, тошнотой, рвотой, диареей, респираторным алкалозом. Эти отрицательные явления исчезают после отмены АСК. Острое отравление АСК может развиваться, если разовая доза превышает 2 г (у детей — 1 г). К описанной симптоматике присоединяются повышение температуры тела, тревога, галлюцинации, маниакальное состояние, судороги, кома. Наблюдаются дегидратация и кетоз, метаболический ацидоз, развиваются геморрагии. Такие больные подлежат лечению в стационаре в целях ликвидации дегидратации, нарушений кислотно-щелочного равновесия. Для выведения АСК из организма промывают желудок раствором натрия гидрокарбоната, назначают адсорбенты, осуществляют форсированный диурез, перитонеальный диализ или гемодиализ. Внутривенно вводят викасол, раствор натрия гидрокарбоната, глюкозы, калия хлорида; проводят переливание крови, обкладывают больного компрессом со льдом.
Фенилбутазон (бутадион) отличается от других пиразолонов более выраженной противовоспалительной активностью, чем у салицилатов, однако аналгезирующий и жаропонижающий эффекты у бутадиона слабее, чем у них. Основные осложнения при использовании препарата — нарушения гемопоэза: апластическая анемия, агранулоцитоз, тромбоцитопения.
При приеме бутадиона и других НПВС нарушается репарация хряща суставов и субхондриальных отделов костной ткани, что может привести к образованию очагов деструкции и кист. При этом НПВС уменьшают боль и явления синовита, но не задерживают дегенеративно-дистрофических изменений в тканях суставов, поэтому их рекомендуют применять только в период обострения воспалительного процесса.
Учитывая наличие большого количества побочных эффектов, бутадион в настоящее время используют для наружного применения в виде 5 %-й мази.
Мефенамовая кислота по аналгетическому действию превосходит АСК. Нифлуфенамовая кислота в виде геля и крема более активна, чем мефенамовая кислота.
Индометацин обладает выраженной противовоспалительной, аналгезирующей и жаропонижающей активностью, его применяют внутрь по 25—50 мг 2—3 раза в день. Быстро и почти полностью адсорбируется из кишечника. Максимальное действие развивается через 2 ч, период полувыведения составляет 7 ч. Индометацин — одно из наиболее активных противовоспалительных средств при ревматоидном артрите, периартритах, анкилостомозирующем спондилите (болезнь Бехтерева), остеоартрозах, подагре, воспалительных заболеваниях соединительной ткани, костно-мышечной системы, тромбофлебите. Применяют его длительное время, при резкой отмене препарата патологический процесс может обостриться.
Побочные эффекты: встречаются у 25—50 % больных даже при применении препарата в небольших дозах, особенно у детей до 7 лет. Характерны диспепсические расстройства, оказывает ульцерогенное действие. Для профилактики отрицательного влияния на ЖКТ препарат необходимо принимать после еды, запивать молоком или раствором натрия гидрокарбоната, применять антацидные средства.
Индометацин может вызвать мигренеподобную головную боль, головокружение, расплывчатость зрительного восприятия, депрессию. Эти явления особенно опасны у лиц, профессия которых требует быстрой психологической и физической реакции. Иногда препарат вызывает аллергические реакции, гранулоцитопению, поражение печени и почек. Противопоказан при язвенной болезни желудка и двенадцатиперстной кишки, при бронхиальной астме. Его не следует назначать женщинам в период беременности и лактации. Индометациновая мазь объединяет в себе высокоэффективное действующее вещество и удобную лекарственную форму, что обеспечивает высокую биодоступность препарата, а также отсутствие системных побочных эффектов.
Ибупрофен — производное пропионовой кислоты; по силе противовоспалительного действия слабее индометацина. Оказывает аналгезирующее и жаропонижающее действие. Как противовоспалительное средство применяют в суточной дозе 0,6—1,2 г. Назначают внутрь 3—4 раза в сутки при ревматоидном артрите, деформирующим остеоартрозе, анкилозирующем спондилезе, особенно если больные не переносят АСК. Ибупрофен иногда вызывает диспепсические расстройства, аллергические реакции. Возможна перекрестная аллергия с пенициллином. Описаны случаи гранулоцитопении.
Диклофенак-натрий (ортофен, вольтарен) — производное фенилуксусной кислоты — по силе противовоспалительного действия превосходит ибупрофен, обладает аналгезирующим и жаропонижающим эффектами и низкой токсичностью, не вызывает деградации гликозаминогликанов и коллагена в суставах. При приеме внутрь максимальный эффект развивается через 2 ч и продолжается 6—7 ч. Применяют при ревматизме, артрозах, спондилоартрозах. Препарат хорошо переносится, иногда наблюдаются диспепсические расстройства, аллергические реакции. При длительном применении возможно ульцерогенное действие. Противопоказан при язвенной болезни желудка и двенадцатиперстной кишки, в первом триместре беременности. При длительном применении необходимо контролировать картину крови.
Кетопрофен подавляет агрегацию тромбоцитов, противовоспалительный эффект при суставном синдроме наступает к концу первой недели.
Пироксикам — производное оксикама, оказывает сильное противовоспалительное действие, хорошо всасывается при приеме внутрь. Максимальная концентрация в крови наблюдается через 3—5 ч, период полувыведения составляет 48—50 ч, суточная доза — 20—40 мг (при увеличении ее до 60 мг действие возрастает, но увеличивается и количество побочных эффектов). Применяют препарат 1—2 раза в сутки. Довольно высок риск развития желудочно-кишечных кровотечений, что объясняется большим периодом полувыделения.
Лорноксикам несколько превышает пироксикам по активности. Мелоксикам преимущественно влияет на ЦОГ-2 и вызывает меньше побочных эффектов со стороны пищеварительного канала.
Основные побочные эффекты, которые наблюдаются при применении НПВС — неселективных ингибиторов ЦОГ, представлены в таблице 2.15.
Лечение воспалительных заболеваний соединительной ткани ревматоидного характера — трудный и сложный процесс, требующий поддержания определенной последовательности. В начале заболевания используют НПВС, главная цель их применения — угнетение воспалительного процесса, уменьшение болей, ригидности мышц и суставов. Вместе с тем они не изменяют течения заболевания. Модифицировать течение заболевания могут препараты базисной терапии.
Средства базисной терапии, применяемые при лечении ревматоидного артрита, системных и других заболеваний соединительной ткани [ править ]
В патогенезе этих заболеваний существенную роль играет гиперчувствительность замедленного типа. В ее осуществлении участвуют цитотоксические Т-лимфоциты, разрушающие клетки, имеющие на своей поверхности антигены; сенсибилизированные Т-лимфоциты, которые посредством своих лимфокинов рекрутируют моноциты, превращая их в макрофаги, активируют секрецию и функцию последних, заключающиеся в цитотоксичности, фагоцитозе поврежденных клеток и пр. Но в патологически измененной синовиальной оболочке суставов (при ревматоидном артрите) или соединительной ткани при ее патологии обнаружены и иммунные комплексы (т. е. Ig и компоненты системы комплемента), и макрофаги, которые освобождают протеолитические ферменты, свободные радикалы кислорода, различные цитокины и т. д.
В развертывании патологического процесса одну из ключевых функций выполняет моно-кин — интерлейкин-1 (ИЛ-1), продуцируемый макрофагами, инфильтрирующими поврежденные ткани, и синовиацитами, приобретающими такую способность. Из-за повышенного его образования активизируются синтез ПГЕ2 и функция нейтрофилов; и то, и другое стимулирует латентные протеазы, разрушающие синовиальную оболочку хряща. При этом образуются метаболиты коллагена, обладающие свойствами эндогенных антигенов, активизируются лимфоциты, освобождающие различные лимфокины, из которых следует отметить ИЛ-2, активирующий пролиферацию Т-лимфоцитов-киллеров, а также лимфокины, передающие сенсибилизацию другим клеткам, образуя их клоны.
При лечении системных заболеваний соединительной ткани применяются так называемые базисные противоревматические средства, для которых характерно развитие медленного эффекта — через несколько месяцев после начала лечения (хингамин, пенициллинамин, препараты золота), цитостатики, а также глюкокортикоиды.
Хингамин (делагил, хлорохин) введен в медицину в качестве противомалярийного средства, но он способен подавлять воспалительные реакции, в которых участвует элемент гиперчувствительности замедленного типа (ГЗТ). Стабилизирует клеточные и субклеточные мембраны лизосом, ограничивая выход из них гидролаз и тормозя этим фазу альтерации обычного воспаления. Кроме того, хингамин подавляет активность нуклеиновых кислот (внедряясь между парами их оснований), в частности лимфоцитов, тормозит продукцию ими лимфокинов, в том числе ИЛ-2, в результате снижается активность и деление Т-лимфоцитов, стимулирующее влияние Т-хелперов на деление моноцитов, продукцию ими ИЛ-1. В результате воспалительный процесс, возникающий из-за попадания антигена в соединительную ткань сустава, постепенно затухает. Применяют его при непрырывно рецидивирующем ревматизме, среднетяжелой форме ревматоидного артрита, системной красной волчанке и некоторых других заболеваниях подобного рода. Терапевтический эффект развивается медленно (через 10—12 нед) при ежедневном приеме препарата. Лечение должно быть длительным — минимум 6 мес, обычно 1—2 года.
Столь длительное назначение препарата может сопровождаться возникновением нежелательных эффектов, связанных с накоплением препарата в тканях (угнетение секреции желудочного сока, нарушение функции печени, дерматит, лейкопения, миопатия). Наиболее опасна ретинопатия, способная привести к слепоте, поэтому при применении препарата надо регулярно контролировать остроту и величину поля зрения, назначать соляную кислоту с пепсином, нестероидные анаболические средства (оротовую кислоту, карнитин и др.).
Пеницилламин (купренил) — продукт метаболизма пенициллина; содержит сульфгидрильную группу, способную связывать многие вещества, в том числе тяжелые металлы. Считается, что пеницилламин образует комплексные соединения с медью, облегчая этим ее доставку в очаги воспаления, в которых обычно снижены и ее содержание и активность супероксиддисмутазы, устраняющие избыток свободных радикалов кислорода, освобождающихся в очаге воспаления и повреждающих мембраны соседних клеток. Образуя комплексные соединения с железом, пеницилламин ограничивает его катализирующую роль в образовании чрезвычайно активного радикала кислорода (ОН). Кроме того, он тормозит образование антигенов коллагеновой структуры.
Применяют пеницилламин преимущественно при лечении активного прогрессирующего ревматоидного артрита. Терапевтический эффект проявляется через 12 нед, отчетливое улучшение — через 5—6 мес. При длительном назначении возможны нежелательные эффекты: высыпания, нарушения функции желудочно-кишечного тракта, временная потеря вкуса, тромбоцитопения (иногда тяжелая с геморрагиями), протеинурия (иногда заканчивающаяся развитием нефротического синдрома).
Препараты золота — кризанол, солганал, ауротиоглюкоза, ауронофин — нарушают захват антигена макрофагами, препятствуют освобождению интерлейкина-1 моноцитами и интерлейки-на-2 лимфоцитами, подавляют пролиферацию Т-лимфоцитов, снижают активность Т-хелперов, образование Ig В-лимфоцитами, ревматоидного фактора, иммунных комплексов, тормозят активацию системы комплемента.
Эти препараты используют для лечения ревматоидного артрита, системной красной волчанки, псориатического артрита и других коллагенозов. Растворы (кризанол, солганал — масляные, ауротиоглюкоза — водный) предназначены для парентерального введения (внутримышечно или непосредственно в область пораженного сустава), ауронофин — препарат для перорального приема.
Иньекции указанных препаратов производят 1 раз в неделю (ауронофин принимают ежедневно) длительное время. Первые признаки улучшения состояния больного могут проявиться через 6—7 нед, отчетливый терапевтический эффект возникает через 10—12 нед. Для получения более выраженного эффекта препараты золота назначают одновременно с нестероидными противовоспалительными средствами или с глюкокортикоидами. Надо отметить, что приблизительно у 25—30 % больных эти препараты оказываются неэффективными, но об этом можно судить после 6 мес их использования.
Осложнения при применении препаратов золота: сыпь, язвы на слизистой оболочке рта, протеинурия, тромбоцитопения и изредка панцитопения, отмечают функциональные нарушения печени, при пероральном применении иногда может возникнуть нитритоидный криз. Пероральный препарат менее опасен, так как выводится стенкой толстой кишки, меньше накапливается в почках и печени.
Цитостатики (циклофосфан, хлорбугин, азатиоприн реже — меркаптопурин, циклоспорин А) применяют при лечении диффузных заболеваний соединительной ткани. Угнетая деление клеток, в том числе лимфоидной ткани, они ограничивают образование иммунокомпетентных клеток и развитие иммунологических механизмов при ревматоидном артрите, системной волчанке и пр. Названные препараты рассматривают как резервные, обычно их применяют при неэффективности других противоревматоидных средств медленного действия.
Назначают их иногда и при тяжелых формах заболевания с ГАТ, так как ингибируя деление Т-лимфоцитов они нарушают их кооперацию с В-лимфоцитами, а следовательно, и образование иммуноглобулинов.
При назначении цитостатиков возможны серьезные осложнения.
Циклоспорин А — это антибиотик, являющийся циклическим пептидом, состоящим из 11 аминокислот. Препарат внедряется в лимфоциты, связывается с цитоплазматическими и ядерными белками, тормозя кодирование синтеза в активированных Т-лимфоцитах лимфокинов, в частности интерлейкина-2, у-интерферона, фактора, ингибирующего миграцию макрофагов, фактора их хемотаксиса. Кроме того, он стимулирует функцию моноцитов (так как подавляет их активирование лимфокинами), в том числе продукцию интерлейкина-1, подавляет генерацию кланов цитостатических клеток-киллеров по отношению к пересаженным тканям. Очень важным является его свойство сохранять и даже повышать активность Т-супрессоров, т. е. циклоспорин А способствует проявлению естественной иммунодепрессии, подавляет отторжение пересаженных тканей и органов. Он меньше других цитостатиков угнетает деление клеток в различных тканях, и при его применении возникает меньше гематологических и инфекционных осложнений.
Применяют циклоспорин А обычно в комбинации с преднизолоном при лечении больных с гломерулонефритом, что позволяет снизить дозу преднизолона и уменьшить количество обострений данного заболевания.
При назначении циклоспорина А необходимо поддерживать его уровень в плазме крови не выше 200—400 мг мл»1, чтобы не допустить развития тяжелых осложнений. При более высоких концентрациях циклоспорина А в крови у больного может нарушиться кровоснабжение почек, уменьшиться диурез, фильтрация в клубочках, повыситься уровень калия в плазме крови и артериальное давление, развиться гиперхлоремический ацидоз, появиться гипомагниемия, проявляющаяся в возникновении тремора, судорог. Кроме того, при приеме циклоспорина А могут наблюдаться гиперплазия десен, торможение образования простациклина эндотелиальными клетками, что способствует тромбообразованию, угнетение функции печени. При неэффективности НПВС и средств базисной терапии и в случаях очень тяжелого течения воспалительного процесса применяют глюкокортикостероиды.
Стероидные противовоспалительные средства
По химическому строению стероидные противовоспалительные средства (СП ВС) относятся к 11,17-оксикортикостероидам. Первыми препаратами этой группы были естественные глюкокортикоиды, выделенные из надпочечников — гидрокортизон и кортизон. В настоящее время осуществлен синтез этих веществ, а также ряда их аналогов и производных.
Из синтетических аналогов СП ВС наиболее часто в клинической практике используют преднизолон (дегидрированный аналог гидрокортизона), метилпреднизолон, а также фторированные производные — дексаметазон, триамцинолон, флуметазон, бетаметазон. При введении в молекулу одного или нескольких атомов фтора происходит существенное повышение противовоспалительной активности препаратов.
Противовоспалительный эффект СП ВС в первую очередь связан с их способностью ингибировать фермент фосфолипазу А2 (ФЛА2 через белок липокортин, индуцируя его образование в лейкоцитах.
Этот фермент участвует в гидролизе мембранных фосфолипидов, освобождая из них арахидоновую кислоту, являющуюся субстратом для синтеза противовоспалительных медиаторов — простагландинов и лейкотриенов. К тому же стероидные противовоспалительные средства угнетают ген, кодирующий образование ЦОГ-2, функционирующей в очаге воспаления, не влияя на ЦОГ-1 в нормальных тканях. Таким образом, глюкокортикоиды существенно подавляют образование простагландинов в очаге воспаления. Кроме того, они обладают анти-оксидантными свойствами, тормозя пероксидное окисление липидов и сохраняя целостность клеточных мембран. Этим они препятствуют распространению воспаления.
Антипролиферативный эффект СП ВС связан с ограничением миграции моноцитов в очаге воспаления и торможением деления тромбобластов, а также ограничением миграции моноцитов в очаге воспаления и торможением деления фибробластов. Они также подавляют синтез мукополисахаридов и этим ограничивают связывание тканями воды и белков плазмы, попавших вместе с экссудатом в очаг воспаления. В результате сокращается развитие фибриноидной фазы ревматического воспаления, а затем и гиалиноза. СП ВС угнетают активность коллагеназы — протеолитическо-го фермента, разрушающего интерстициальный коллаген и вызывающего деструкцию костей при ревматоидном артрите.
Используют стероидные противовоспалительные средства при всех формах активного ревматизма и прежде всего — при первичном ревмокардите, красной волчанке, ревматоидном артрите. Для получения наилучшего эффекта их рекомендуется вводить локально, т. е. делать внутрисуставные, интрасиновиальные и другие инъекции. Курс лечения обычно длится 1—2 мес, отмена препаратов должна проводиться медленно. Часто глюкокортикоиды в острой стадии ревматоидного процесса или при ревматоидном артрите сочетают с НПВС, потому что под влиянием комплексной терапии в более короткие сроки и у большего числа больных уменьшаются признаки поражения сердца, суставов, формирование пороков. (Побочные эффекты и дозы СПВС см. в соответствующем разделе.)
Применение в спортивной медицине и в практике спортивной подготовки [ править ]
Напряженная интенсивная тренировка — это практически всегда своего рода травматизация, сопровождающаяся воспалением. Происходит физиологическое изнашивание активно работающей мышечной ткани, распад биологических структур, да и сам процесс тренировки чреват постоянным риском образования микро- и макротравм (вывихи, растяжения, ушибы и даже частичные или полные разрывы мягких тканей). При этом следует учитывать: чем выше квалификация атлета и процент мышечной массы в организме, тем больше возможность развития процессов аутотравматизации вследствие мощнейших произвольных сокращений мышечных волокон и некоторого отставания биологической прочности мышечной и связочно-суставной ткани от функциональных возможностей центральной нервной системы и поперечнополосатой мускулатуры. Этот дисбаланс сам по себе способствует активному применению различных допинговых препаратов, стимулирующих работоспособность, в том числе анаболических стероидов, что запрещено WADA.
Применение НПВС для лечения спортивных травм давно распространено и достаточно популярно в практике спортивной медицины. Используются различные лекарственные формы, а именно — мази, гели, линименты, таблетки, инъекции, свечи, пластыри.
Как уже указывалось, общим механизмом действия НПВС является ингибирование синтеза медиаторов воспаления, простагландинов, а также уменьшение отека и периферическое аналгези-рующее воздействие. Одно из свойств НПВС — их способность влиять на реологические свойства крови путем воздействия на мембрану клеток крови. Эти средства препятствуют агрегации (слипанию) клеток крови, образованию стазов (застоев крови в капиллярах и прекапиллярах), формированию тромботических масс. Весь этот комплекс проявлений фармакологических свойств способствует уменьшению болевого синдрома, снижению отечности, замедлению и приостановке воспалительных реакций, более быстрому восстановлению функции поврежденного органа или ткани.
В популярной спортивной литературе, особенно изданной в США, иногда рекомендуются чрезмерные дозировки НПВС — например, до 12 г ибупрофена в сутки. Конечно, ориентироваться на них нельзя. Возможно увеличение указанной в инструкции дозировки максимум на 20-40 %.
Применение НПВС показано при различных травмах легкой и средней степени тяжести (растяжениях, ушибах, вывихах, надрывах мышц и связок), а также при микротравмати-зации мягких тканей и опорно-двигательного аппарата. Однако нельзя не учитывать, что современные высокоэффективные НПВС, обладая мощным противовоспалительным и анальгетическим эффектом, часто маскируют болевые сигналы организма о надвигающейся серьезной угрозе в виде тяжелой травмы — чаще всего, опорно-двигательного аппарата или мягких тканей. Используя эти средства, спортсмен часто продолжает тяжелые и интенсивные тренировочные занятия, усугубляя патологический процесс и превращая микротравму в серьезное органическое поражение суставов, связок, сухожилий или мышц с формированием рубцового замещения биологически активных тканей организма. Когда боль становится нестерпимой, реабилитационные мероприятия бывают крайне длительными и малоэффективными. Очень часто в таких случаях требуется оперативное вмешательство, в то время как тяжелой травмы можно было избежать. Всегда следует помнить, что НПВС не являются этиологическими и патогенетическими средствами лечения патологического процесса; основное их действие заключается в уменьшении и частичном устранении симптомов воспаления.
Не следует забывать, что влияние НПВС на реологические свойства крови может значительно усилить кровотечение или даже вызвать его в том случае, когда его могло и не быть.
Таким образом, НПВС могут оказать существенную помощь только при корректном назначении и правильном применении.
В принципе, назначение СП ВС в спортивной медицине наиболее оправдано в лечении различных как острых, так и хронических спортивных и бытовых травм мягких тканей, суставов, надкостницы и т. п. Применяется как общая и местная, так и очаговая терапия — введение препарата непосредственно в сустав или околосуставные ткани. Обязательно надо учитывать, что использование глюкокортикоидов, особенно в течение длительного времени, в значительной степени снижает стрессовую реактивность надпочечников и адаптационный потенциал организма. Побочные эффекты, в частности, атрофия коры надпочечников, могут оказаться необратимыми.
